2. ALAPFOGALMAK 
2.2 A RÁK FENNMARADÁSA: ÉRELLÁTÁS, IMMUNVÉDEKEZÉS
A normális és a daganatos sejtek egyaránt nőnek, osztódnak, szaporodnak, elhalnak, regenerálódnak. A daganatos sejtek viselkedése eltér a normálistól, legfőbb jellemzőjük a gátnélküli szaporodás, továbbá a sejtpusztulás háttérbe szorulása. A két sejttípus között az alapvető különbség a sejtszaporodást szabályozó genetikai állomány, az abban tárolt információ alapján előállított fehérjék, illetve anyagcsere folyamatok között van.
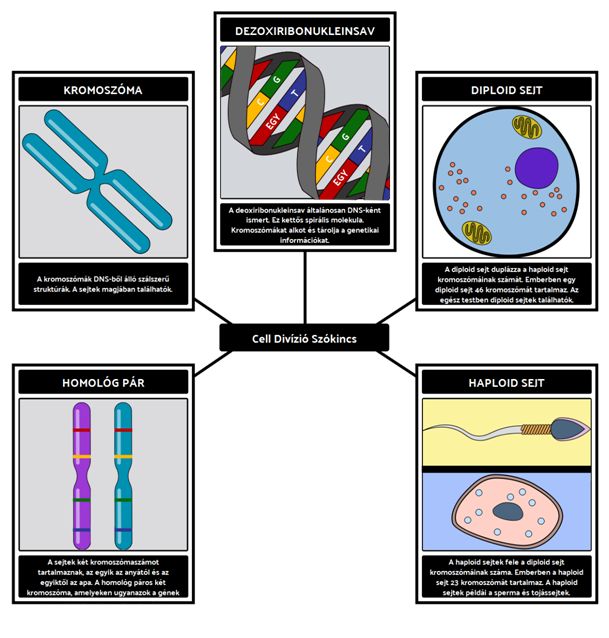
Genetikai állomány:
- DNS: a DNS kódolja a fehérjék építőköveit, szigorú rend szerint következő nukleotidokból épül fel.
- gén: a gén DNS molekulák jellemző sorrend szerint felépülő szakasza, mely meghatározott molekulákat, fehérjéket kódol.
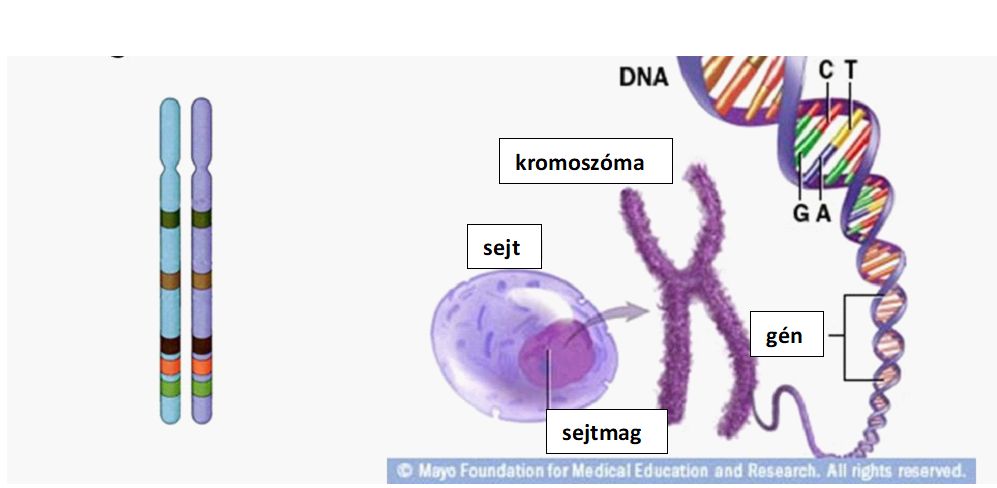
- kromoszóma: a kromoszóma számos különféle génből, és gének közötti szabályozó szakaszokból felépülő nagyobb DNS darab. Többnyire egy pár kromoszóma együttes jelenléte és hatása kell a zavartalan életműködésekhez (kivéve az X és Y kromoszómák esetében).
- hírvivő („messenger”) RNS: a génátírás során keletkező végrehajtó molekula, mely a fehérje képzéséhez szállítja az információt (2.1 ábra).
A.
B.
2.1 ábra A sejtműködés néhány alapfogalma
Ma már rendelkezünk számos gyakoribb daganat szövetminta teljes örökítő anyag (genom) térképével. A daganatokban mindig egy vagy több valamilyen, a normálistól eltérő működést okozó hiba mutatható ki a genetikai állományban. Ezt mutációnak hívják, amely szigorú értelemben mindig az örökítő anyag eltérését jelenti. Legtöbbször a gén, vagy a DNS molekula hibájáról van szó, de akár pusztán szabályozási zavar is magyarázhatja a rendellenes életműködéseket, vagyis a normálisan is előforduló anyagcsere folyamatok sebessége, vagy az azokhoz szükséges molekulák mennyisége nő meg, vagy csökken le. Sok esetben a normálisan jelenlévő génjavító mechanizmusok is gyengék, és a daganatokban a mutációk gyorsabban szaporodnak, illetve kiválogatódás miatt (az életképesebb sejtcsoportok, klónok maradnak fenn) változnak. Minél előrehaladottabb a rák, annál több génhiba található benne, és annál életképesebb. A génhibák száma nem csak a daganat, hanem a beteg életkorával arányosan is több (2.2 ábra).
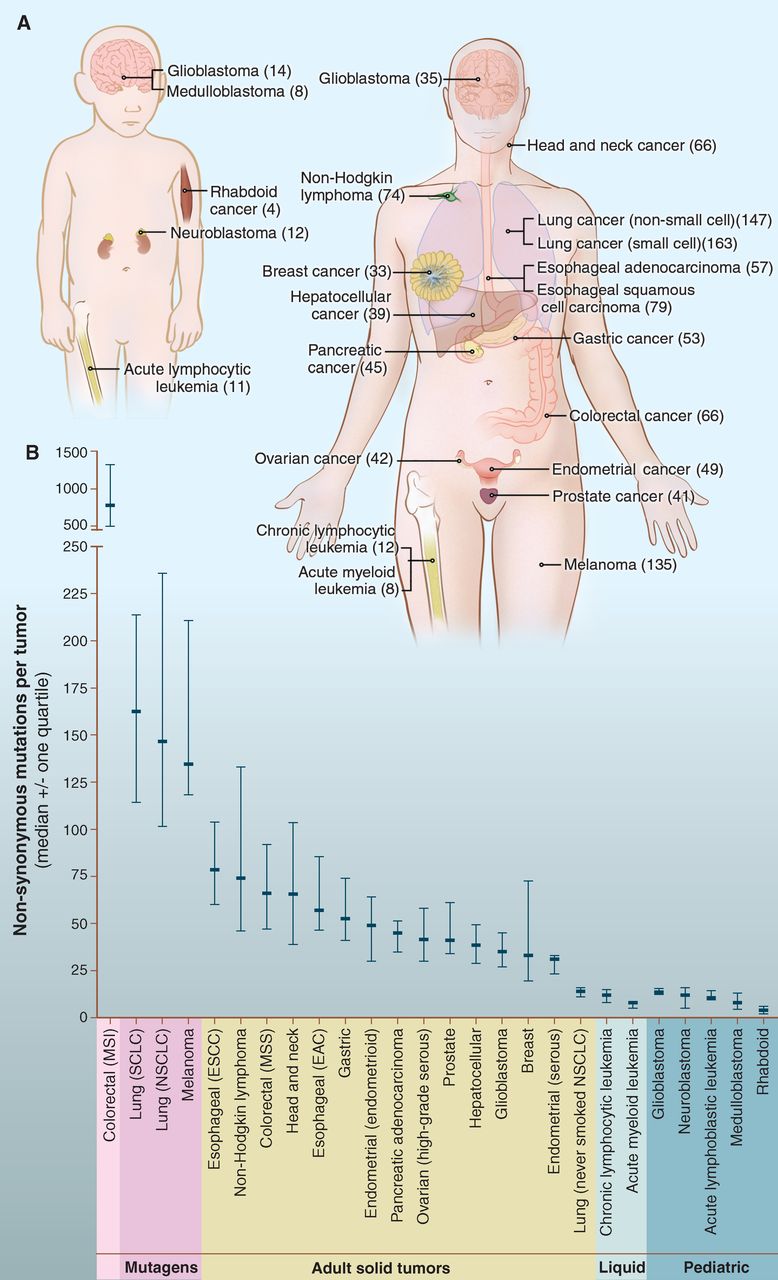
2.2 ábra A daganatokban található mutációk száma daganattípus szerint. Felnőttkorban a daganatok több mutációt tartalmaznak, mint gyermekkorban.
(Vogelstein B, et al. Cancer genome landscapes. Science 29;339(6127):1546-58, 2013)
A génhibák leggyakrabban a DNS építő elemeiben fordulnak elő, de akár a gének áthelyeződése, vagy kromoszóma hiba is állhat a háttérben. Nem mindig a fehérjét kódoló DNS szakasz a hibás, lehet az az átírást szabályozó génszakasz is akár.
A sejtekben rengeteg géneltérés keletkezik. A daganat kialakulásáért, és a daganatos tulajdonságokért felelős génhibát („driver génhiba”) fontos elkülöníteni az ártatlan géneltérésektől („passenger génhiba”), hiszen csak az előbbiek gátlása lehet eredményes a daganat ellen. Tehát, igen, azért is fontos a génhibák feltérképezése, mert a felelős eltérés befolyásolása megszünteti azokat a létfeltételeket, amelyek a daganat fennmaradásához szükségesek.
A kóros sejtműködéshez, sejtszaporodáshoz végül a kóros fehérjék jelenléte vezet, tehát ezek szerepe fontos, gyakran könnyen kimutatható, sőt célzottan támadható is.
Kommunikáció: Szignálátviteli hálózatok
Minden sejtben sok-sok molekula alkotta hálózatok összessége gondoskodik az életműködések finomra hangolásáról (2.3 ábra). A sejtfelszíni receptorok, sejten belüli molekulák, és az örökítő anyag bonyolult kommunikációja a sejten kívül található molekulákkal, vagy éppen sejtekkel bonyolult szabályozást biztosít. A daganatsejtekben ez a szabályozási mechanizmus kórossá válik. Az életfolyamatok torzulása eredményezi a daganatos viselkedést, vagyis a túlzott sejtszaporodást, a sejtpusztulás csökkent voltát, a terjedést és áttétképződést. Ha ezeket az elromlott hálózati működéseket megváltoztatjuk, megszelídíthetjük, vagy akár életképtelenné tehetjük a daganatot.
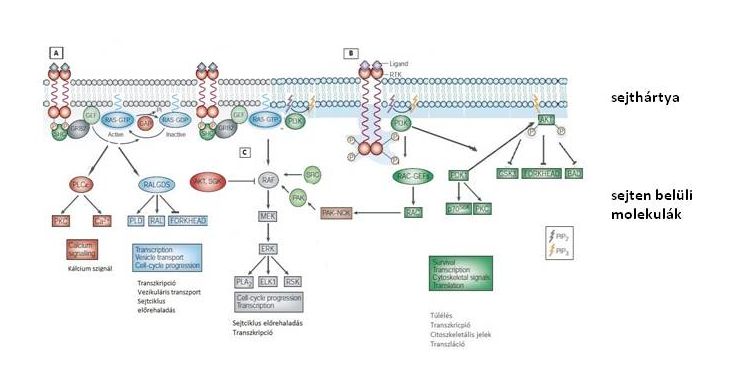
2.3 ábra Példa a sejten belüli szignál átviteli hálózatokra
Mitől keletkeznek a génhibák?
A génhibák keletkezhetnek belső kóros anyagcsere vagy gyulladásos folyamatok eredményeképp, környezeti hatásra (pl. sugárzás, füst, kémiai anyagok), vagy fertőzések (pl. vírus, baktérium) hatására. Ilyenkor a géneltérések csak a daganatszövetben mutathatók ki. Ennél sokkal ritkábban, az esetek kb. 10%-ban örökletes génhiba (szülőktől örökölt, vagy a fogamzás körüli időben keletkező) okozza a későbbi daganatkeletkezést, mely sokszor a meglévő, minden sejtünkben kimutatható génhibán kívül további géneltérések felszaporodását segíti a keletkező daganatban (2.4 ábra).
2.4 ábra Veleszületett és szerzett génmutációk
Veleszületett génmutációk csak a betegek töredékénél fordulnak elő, és hajlamosítanak arra, hogy akár a természetes biológiai folyamatok során valami spontán „elromoljon”, és emiatt daganat jelenjen meg a szervezetben, akár, hogy a külső rákkeltő hatások könnyebben vezessenek rákhoz. Mint írtuk, az esetek legfeljebb 10%-nál tudunk ilyen eltérést igazolni. Bár ezek a test valamennyi sejtjében kimutathatók általában, a géneltéréshez köthető tipikus daganat mégis a génmutációra jellemző szervi lokalizációban jelenik meg. Ez azt jelenti, hogy például a BRCA mutációk leggyakrabban emlő, petefészek, esetleg hasnyálmirigy és prosztata rákot okoznak.
Az úgynevezett sporadikus (nem örökletes) daganatok esetében kimutatható szerzett génhibák, génmutációk evvel szemben csakis a test egy szervében a már leírt okok miatt keletkező daganatban jelennek meg, más szövetben nem mutathatók ki a szervezetben. Itt nagy szerepe van a kiváltó oknak abban, hogy melyik szerv daganata jelenik meg: például a dohányzás elsősorban a tüdőrák, a fejnyaki daganatok, a húgyhólyagrák, veserák kialakulását sietteti. A nem örökletes emlőrákok legtöbbje anyagcserezavarhoz köthető: a túlzott kalória bevitellel kapcsolatos metabolikus szindróma mellett halmozódik, de akár hormonális és persze egyéb oka is lehet. A szerzett lényeges (úgynevezett driver) génhibák sem egyformák a különféle daganatokban, hanem jellemzők egy adott daganat típusra vagy ritkábban egyéniek.
A sejt a keletkezett DNS sérülésekre normál esetben számos összetett folyamattal reagál. Ezt összefoglaló néven DNS károsodás válasznak nevezzük. Két fő komponense a DNS hibajavító mechanizmusok (2.5 ábra), és a sejtciklus ellenőrző pontok működése.
2.5 ábra DNS hibajavítás: normálisan különféle mechanizmusok összehangolt működése teszi lehetővé
(Jackson SP, Bartek J; The DNA-damage response in human biology and disease. Nature. 2009; 461:1071-8. alapján)
Molekuláris diagnosztika emlőrákban
Sejthalál
A daganatok fontos jellemzője, ami a korlátlan osztódáshoz is hozzájárul, illetve nagyon ellenállóvá teszi a daganatos sejteket, hogy képesek kikapcsolni az öregedéshez, sejthalálhoz vezető útvonalakat, azaz halhatatlanok. Vagyis a daganatsejtek esetében nem működik, illetve háttérbe szorul a programozott sejthalál, az apoptózis.
2.2 A RÁK FENNMARADÁSA: ÉRELLÁTÁS, IMMUNVÉDEKEZÉS
2.2.1. A RÁK FENNMARADÁSA: ÉRELLÁTÁS
A daganatos sejtek csoportja 1-2 mm-es méret felett csak saját érrendszer megléte esetén marad fenn. Ahhoz, hogy ez a daganatos érhálózat kialakuljon, különféle biológiai feltételek szükségesek, amelyet az ér újdonképződés, angolul neoangiogenezis biztosít. Ezt a folyamatot a daganatsejtek és az egészséges sejtek közötti kémiai kommunikáció támogatja (2.6. ábra). A daganat érhálózata biztosítja a tápanyag- és oxigénellátást, és emellett a daganatokra jellemző kóros anyagcsere-környezetet. Emiatt nehéz a gyógyszerek érvényesülése, emiatt gyakori a gyógyszer rezisztencia. Ma már rendelkezünk az ér újdonképződést befolyásoló, gátló kezelési eljárással, mely közömbösíti az érbenövést serkentő üzenetek érvényesülését, így a daganat túlélését akadályozhatja meg.
2.6 ábra Ér újdonképződés: a daganatsejtek és a környezet egymásra hatása kémiai üzenetváltással
(Ferrara N, Kerbel RS; Angiogenesis as a therapeutic target. Nature. 2005;15; 438:967-74.)
2.2.2. DAGANATELLENES IMMUNVÉDEKEZÉS
Az immunrendszer nem csak a fertőzésekkel szemben nyújt védelmet, hanem részt vesz a daganatellenes védekezésben is. A daganatsejtek bár rendelkeznek sejtfelszíni antigénekkel, mégis képesek leállítani az immunsejtek aktiválódását és elrejteni, felismerhetetlenné tenni magukat a rendszer számára. Ebben a rejtőzködési képességben is fő szerepet játszanak a daganatsejtek, illetve az immunsejtek felszínén lévő molekulák, melyek gátlásával javulhat a daganatellenes immunvédekezés.
Az immuno-onkológia és az immuno(onko)terápia az immunrendszer daganatok elleni védekezésben játszott szerepével és lehetőségeivel foglalkozik, célja, hogy a daganatos sejtek pusztulását a szervezet saját immunválaszának fokozásával érjék el. A daganatellenes küzdelem egyik legújabb módszere ez, lehetőség a daganatellenes immunválasz felerősítésére, a szervezet tumor által irányított immunfolyamatainak módosítására, valamint daganatgátló immunsejtek generálására.
A daganatsejtek fennmaradásához elengedhetetlen az immunvédekezés elégtelensége, vagyis ha az immunrendszer felismeri a daganatot, és a daganatellenes immunvédekezés jól működik, akkor a daganatot akár felfedezése előtt megsemmisíti. Mint láttuk, a daganat maga is rendelkezik olyan mechanizmusokkal, amelyek csendesítik az immun mechanizmusokat, gyengítik a daganatsejt felismerésének lehetőségét, vagyis a daganat maga felelős a daganatellenes védekezés meggyengítéséért (2.7 ábra).
2.7 ábra A tumorsejtek és mikrokörnyezetük kölcsönhatása az immunrendszerrel
A ráksejtek szaporodása, a daganat tömegének növekedése tulajdonságainak markáns változását, és „veszélyességének” fokozódását hozza magával: saját érhálózata alakul ki, saját anyagcseréje lesz, „sokszínűvé” válik, vagyis különféle részei és alkotóelemei eltérőek, és ezek más-más körülmények között (ugyanis más-más szervbe kerülve vagy eltérő anyagcsere környezetben) tudnak uralkodóvá válni. Ahogy nő a daganat, tönkreteszi a környezetét alkotó szöveteket, azoknak a vér- és nyirokérellátásába terjedhet. Ez utóbbi esemény lehetőséget teremt arra, hogy daganatos részecskék, daganat csírák az ereken keresztül a keringésbe jussanak, majd letapogatva a különféle szervek szöveti környezetét, lehorgonyozzanak valamelyik távoli szervben, ahol növekedve később (növekedési ütemüktől függően rövidebb-hosszabb idő múltán) valódi áttétté váljanak. Ahogy az áttétképződés teóriáját Stephen Paget angol sebész már 1889-ben leírta, a „seed and soil: mag és termőföld” koncepciónak megfelelően a különféle daganatok eltérő áttétképződést mutatnak (2.8 ábra).
A tumorok növekedésük és fejlődésük során egyre több gén mutációját halmozzák fel, ami különböző sejtféleségek kialakulását, és párhuzamos osztódását eredményezi. Minél nagyobb egy tumor tömeg, annál heterogénebb, különbözőbb sejt populációk alkotják, melyekre jellemző a biológiai sokféleség: eltérő a mozgatórugóként funkcionáló „driver” gén, és eltérő áttétképző potenciáljuk is. Evvel magyarázható, hogy minél előrehaladottabb egy daganat, annál nehezebb legyőzni, hiszen a sokféle daganatsejt ellen többféle ellenszert kellene alkalmazni.
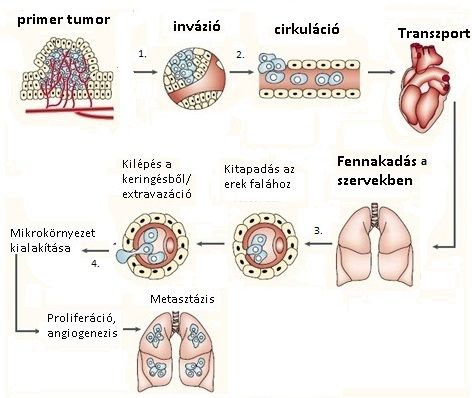
2.8 ábra A metasztázis képződés általános pathomechanizmusa
(Fidler IJ; The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003;3:453-8.)
Az elsődleges daganat vagy akár áttéti daganat terjedésének (progressziójának) folyamata az alábbi lépésekből áll:
- Behatolás a környező szövetekbe (invázió): az első lépés, amely során először megváltozik a tumorsejt kapcsolata az egészséges szöveteket alkotó sejtekkel és sejtközötti állománnyal (extracelulláris mátrix). Ezt a kapcsolatot speciális molekulák közvetítik, melyet a daganatsejt terjedésének szolgálatába állít, megváltoztat. A másik fontos lépés a lebontó enzimek (proteázok) toborzása, amelyek utat képeznek a sejtközötti állományban a tumor sejt számára a vándorláshoz. A harmadik fontos lépés a daganatsejt mozgékonyság, motilitás biztosítása, amely fizikailag teszi lehetővé, hogy a tumoros sejt a szöveteken átjusson. A levált tumorsejt végül migrációval bejut a vér- vagy a nyirokerekbe.
- Keringésbe jutás (cirkuláció, transzport): a tumorsejtek vagy magányosan, vagy csoportosan, sokszor védőburokba csomagolva keringenek a vérben. Nagyrészük azonnal elpusztul a véráramlás okozta nyíróerő hatására vagy immunsejtek által, azonban amelyek túlélnek, megrekedhetnek a távoli szervek kapilláris rendszerében.
- Kijutás a keringésből (extravazáció): a tumorsejt kitapad az érfalhoz, majd feltehetően hasonló folyamatok révén, mint az inváziónál, kilép a keringésből. Az elakadásban szerepe lehet fizikai akadálynak (a kapilláris rendszer szűk keresztmetszete), de sok esetben az elakadás és a kitapadás inkább a tumorsejt és az ér mikrokörnyezetének kölcsönhatása miatt jön létre.
- Áttét kialakulása (mikrometasztázis, kolonizáció): az új környezetbe került sejt a következő feladata az alkalmazkodás, amely függ attól is, hogy a tumorsejt és az új környezet kölcsönhatásba tud-e lépni egymással („mag és termőföld elv”), ez a sikeres kolonizáció alapja. Ha sikerült, és a feltételek kedvezőek, a tumor sejt növekedés, szaporodás elindul, az áttét növekszik, és bizonyos méret után az elsődleges tumorhoz hasonlóan új vérerek képzésével biztosítja a fennmaradást.