3. MOLEKULÁRIS DIAGNOSZTIKA EMLŐRÁKBAN 
3.1 Hagyományos patológiai diagnosztika
3.2 Molekuláris patológiai diagnosztika
3.3 Örökletes emlőrákhoz kapcsolható génhibák
3.1 HAGYOMÁNYOS PATOLÓGIAI DIAGNOSZTIKA
A patológusnak, illetve patológiai diagnosztikának kulcsszerepe van az onkológiai ellátásban, segítő munkája alapfeltétele a jó daganatellenes kezelésnek. Itt általános követelmény a daganat szövettani típusának ismerete. A szövettani vizsgálat lehetőséget ad a daganat kiindulási helyének és szövettani típusának tisztázására, fontos a differenciáltság mértékének (például grade vagy az életképességet, osztódási ütemet jelző úgynevezett proliferációs markerek) ismerete, hiszen sok esetben ettől függ, hogy onkológiai kezelésre szükség van, vagy nincs, máskor eszerint választhatunk a különféle terápiás opciók közül. A molekuláris jellemzés hagyományosan úgynevezett immunhisztokémiai vizsgálattal történik, vagy újabban molekuláris patológiai módszerekkel. Ennek legnagyobb jelentősége az egyénre szabott onkológiai terápia kiválasztásában van: ma számos olyan molekuláris célpont ellen rendelkezünk gyógyszerrel, mely a daganatot előidézte, vagy felelős a rosszindulatúságért – alapvető tehát ezek kimutatása, hiszen jelenlétük adott esetben a sikeres terápia feltételét jelentik.
A hagyományos (immunhisztokémiai) patológiai vizsgálattal számos molekuláris jellemzőt vizsgálnak rutinszerűen (3.1. Táblázat).
3.1 táblázat Hagyományos (immunhisztokémiai) patológiai vizsgálatok emlőrákban
|
Jellemző (szokványos rövidítés) |
Információ-tartalma |
Vizsgálat módja általában |
Prognózis |
Kezelésre vonatkozó következtetés (prediktív szerep) |
|
Ösztrogén receptor (ER) |
A női nemi hormon ösztrogének hatása jelentős |
Immunhisztokémiai meghatározás szövettani metszeten |
Egyéb jellemzőkkel együtt információt adhat |
Endokrin terápia várható hatékonyságát jelzi, a kezelés feltétele |
|
Progeszteron receptor (PR) |
A női nemi hormon ösztrogének hatása jelentős |
Immunhisztokémiai meghatározás szövettani metszeten |
Egyéb jellemzőkkel együtt információt adhat |
Endokrin terápia várható hatékonyságát jelzi |
|
Humán epidermális növekedési faktor receptor-2 (HER2) |
A HER2 molekula onkogén szerepe |
Immunhisztokémiai meghatározás szövettani metszeten |
Kezelés nélkül kedvezőtlen, célzott kezeléssel kedvező |
HER2-gátló terápia hatásosságát jelzi, a kezelés feltétele |
|
Proliferációs marker Ki67 (Ki67) |
Fokozott osztódási hajlam |
Immunhisztokémiai meghatározás szövettani metszeten |
Egyéb jellemzőkkel együtt információt adhat |
Kemoterápia hatásosságának valószínűségét előrejelzi |
|
Topoizomeráz-2 alfa (TOP2A) |
Fokozott osztódási hajlam és a topoizomeráz enzimtől való függőség |
Immunhisztokémiai meghatározás szövettani metszeten |
Egyéb jellemzőkkel együtt információt adhat |
Kemoterápia (főképp antraciklinek) hatásosságának valószínűségét előrejelzi |
|
Programozott sejthalál ligand-1 (PD-L1) (Egyelőre csak előrehaladott/áttétes esetben vizsgálják) |
A daganat túlélésében van szerepe az immunsejtek előli rejtőzködésnek |
Immunhisztokémiai meghatározás szövettani metszeten, pozitivitás az immunsejteken |
? |
Immun checkpoint gátlók hatásosságát vetíti előre, de jelenlétének hiánya nem zárja ki annak lehetőségét |
|
Daganatot infiltráló lymphocyták (TIL) |
Daganatellenes immunvédekezés jelenlétét mutatja |
Hematoxylin-eozin festett szövettani metszeten stromális lymphocyták jelenléte |
Jó prognózist jelez |
Kemoterápia, HER2 gátló terápia (HER2 pozitív daganat esetén!) eredményessé-gét jelzi |
A patológiai vizsgálatot egyaránt lehet a tumorból vett szövettani mintán, biopszián, vagy a műtét során eltávolított anyagon végezni. Amennyiben hosszú lefolyású betegségről van szó, érdemes újabb és újabb szövettani mintavétellel követni a daganat esetleges változását, amely ismeret a kezelést is befolyásolja, hatékonyabbá teszi. A mintavétel speciális formája az úgynevezett folyékony biopszia („likvid biopszia”), mely legtöbbször vérvétellel kezdődik, és a vérből a daganat vérkeringésbe jutott elemeinek vizsgálatát jelenti molekuláris genetikai módszerrel. (Megkülönböztetjük az úgynevezett keringő tumor markerektől, melyek ugyancsak a daganatból származó anyagok, és arra jellemzők, - mennyiségük, szintjük arányos a szervezetben lévő daganattal, de a daganatok finom jellemzésére nem alkalmasak.) Előnye a nem megterhelő beavatkozás és gyakori mintavételi lehetőség, mely a betegség érzékeny monitorozására (kiújulás, javulás-romlás, a kezelésre kialakuló rezisztencia korai kimutatása) teremt lehetőséget.
3.2 MOLEKULÁRIS PATOLÓGIAI DIAGNOSZTIKA
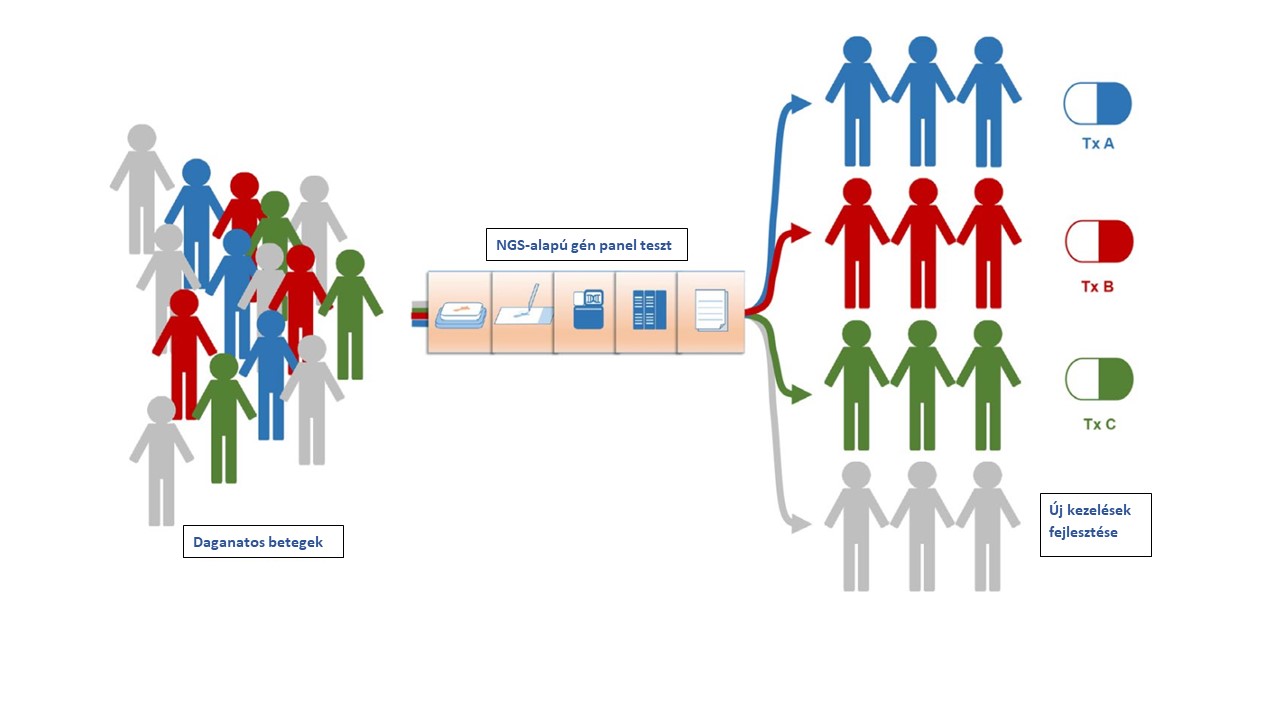
3.1 ábra A daganatok molekuláris patológiai módszerekkel történő részletes jellemzésével a betegeket különféle, a számukra legelőnyösebb kezelésekre sorolják.
(Nagahashi M, et al. Cancer Sci 2019, 110:6-15.)
A molekuláris patológiai diagnosztikai módszerek a gének vizsgálatával sokszor még megbízhatóbban jellemzik a daganatokat, mint a hagyományos biomarkerek. Kellő információ esetén ezek mintegy a daganat ujjlenyomatát adva segítenek az esetek megkülönböztetésében, és hatékony kezelésében. A betegektől vett különféle minták vizsgálata sokféle lehet. Az egy, vagy előre kiválasztott néhány gén vizsgálata nagy lehetőséget jelent a kifinomult, egyénre szabott kezeléshez. A vizsgálat irányulhat a gyógyszeres kezelés feltételeként felmerülő egyetlen génre, vagyis, hogy az hibátlan, vagy mutat valami eltérést. Máskor egyszerre több, a kezelés vagy esetleg prognózis (várható kimenetel) szempontjából bizonyítottan fontos több gént vizsgálnak, vagyis egy előre meghatározott génpanelt. Végül újabban akár nagyon sok, vagy az összes gén vizsgálatát is elvégzik, az utóbbihoz új, gyors és költséghatékony módszer, az új generációs szekvenálás („next generation sequencing” NGS) elterjedése vezetett. Ez a módszer háttérbe szorítja a hagyományos („Sanger-féle”) szekvenálást és a PCR módszert. Ma már egyszerű módszernek számít az in situ hibridizáció (FISH – fluorescens, vagy CISH - chromogen vizsgálat), mely a gének sokszorozódását vagy éppen hiányát derítheti fel. A génvizsgálat eredménye utal a várható kimenetelre, gyógyszerérzékenységre, vagy éppen rezisztenciára. Egyes gének speciálisan előírt vizsgálata feltétele lehet bizonyos hatóanyagok alkalmazásának.
Az emlőrák esetében érdemes külön foglalkozni a korai emlőrákban és az előrehaladott/áttétes betegségben alkalmazott génvizsgálatokkal.
3.2.1 MOLEKULÁRIS PATOLÓGIAI DIAGNOSZTIKA KORAI EMLŐRÁKBAN
Több olyan multigén vizsgálat áll rendelkezésre, amely becslést ad az operált daganat várható gyógyulására vonatkozóan, és egyikük (Oncotype Dx) a legmegfelelőbb kezelés kiválasztásában is segít. Ezek többsége csak a daganatok bizonyos csoportjában (HER2 negatív és hormon receptor pozitív) indokolt. A vizsgálatokat általában a műtét során eltávolított daganatszöveten végzik el, a vizsgálat néhány napot vesz igénybe. Bár meglehetősen költséges, Magyarországon a NEAK (Nemzeti Egészségbiztosítási Alapkezelő) az Oncotype DX elvégzését támogatja bizonyos esetekben; a vizsgálat eredményeképpen számos esetben eltekintenek a kemoterápiától.
3.2 táblázat Multigén vizsgálatok korai emlőrákban
|
Jellemző |
Oncotype DX (Genomic Health) |
MammaPrint (Agendia) |
Prosigna PAM 50 (NanoString Technologies) |
EndoPredict (Myriad Genetics) |
|
Információ-tartalom |
Kiújulási kockázat és kemoterápia haszna |
Kiújulási kockázat és kemoterápia haszna |
Kiújulási kockázat és altípus |
Kiújulási kockázat |
|
Leírás |
21 gén expresszió PCR-ral |
70 gén expressziós profil (microarray) |
50 gén expressziós profil |
12 gén expresszió PCR-ral |
|
Meghatározás helye |
Központi laboratórium (USA) |
Központi laboratórium (Hollandia) |
Helyi laboratórium |
Helyi laboratórium |
|
Stádium, amelyben javasolt |
I-II |
I-II |
I-IIIA |
korai |
|
Nyirokcsomó státusz, amelyben javasolt |
negatív vagy <4 pozitív |
negatív vagy <4 pozitív |
Negatív vagy pozitív |
negatív vagy <4 pozitív |
|
Hormon receptor státusz |
ER+ |
ER+ és ER- |
ER+ |
ER+ |
|
HER2 státusz |
HER2- |
HER2- és HER2+ |
HER2- |
HER2- |
|
Menopauzális státusz |
Bármelyik |
Bármelyik |
Csak menopauza |
Bármelyik |
|
Teszt eredmény: rizikó |
Alacsony, közepes és magas |
Alacsony és magas |
Alacsony, közepes és magas |
Alacsony és magas |
|
Magyarországi képviselet |
Med-Gen Sol Kft. |
Gutta Hungary Kft. |
Biomedica Hungária Kft. |
- |
ER: ösztrogén receptor, HER2: humán epidermális növekedési faktor-2
3.2.2 MOLEKULÁRIS PATOLÓGIAI DIAGNOSZTIKA ELŐREHALADOTT/ÁTTÉTES EMLŐRÁKBAN
A molekuláris jellemzésnek óriási jelentősége van előrehaladott, vagy áttétes emlőrákban. Ma már tudjuk, hogy a molekuláris célzott terápiák a diagnózis felállításakor minél korábbi kezelési vonalban történő alkalmazása nem csak hogy eredményes és kíméletes módszer, de a túlélés megnyújtásához vezet. Ezek alkalmazásához sokszor elengedhetetlen a molekuláris vizsgálat, és a betegség életvégig tartó kezelésének megtervezéséhez felbecsülhetetlen segítséget ad. Emiatt az áttétes betegség megállapításakor az első teendő a molekuláris tipizálás. Minél érzékenyebb módszerrel végezzük el a vizsgálatot, annál több információt szolgáltat, és annál hatékonyabb lehet a terápia tervezés. Az áttétes betegség kezelése folyamán elvégzett ismételt vizsgálatok felderítik a daganat esetleges változását, és az alkalmazott kezelésre kialakuló rezisztencia veszélyét.
Alább az előrehaladott daganatokban előforduló géneltéréseket, és a célzott terápia lehetőségét foglaljuk össze. A génhibák gyakorisága az emlőrák típustól függően változik.
3.3 táblázat Multigén vizsgálatok előrehaladott emlőrákban
|
Csoport |
Molekula |
Eltérés |
Gyakoriság (%) |
Gyógyszercsoport |
|
Növekedési tényező receptorok |
HER2 |
amplifikáció, mutáció |
>10 |
HER2 gátló |
|
|
FGF3 |
amplifikáció |
5-10 |
FGFR gátló |
|
|
FGFR1 |
amplifikáció |
5-10 |
FGFR gátló |
|
|
FGFR2 |
amplifikáció |
1-5 |
FGFR gátló |
|
|
IGF1R |
amplifikáció |
1-5 |
IGFR gátló |
|
|
EGFR |
amplifikáció |
1-5 |
EGFR gátló |
|
|
|
|
|
|
|
PI3K/AKT/mTOR |
PIK3CA |
amplifikáció, mutáció |
>10 |
PIK gátló |
|
|
PIK3R1 |
amplifikáció, mutáció |
1-5 |
? |
|
|
PTEN |
amplifikáció, mutáció |
5-10 |
AKT gátló |
|
|
AKT1 |
amplifikáció, mutáció |
1-5 |
AKT gátló |
|
|
AKT2 |
amplifikáció |
1-5 |
AKT gátló |
|
|
AKT3 |
amplifikáció |
1-5 |
AKT gátló |
|
|
|
|
|
|
|
MEK |
NF1 |
mutáció |
1-5 |
MEK gátló |
|
|
KRAS |
amplifikáció |
1-5 |
MEK gátló |
|
|
BRAF |
amplifikáció |
1-5 |
MEK gátló |
|
|
|
|
|
|
|
Sejtciklus |
CCND1 |
amplifikáció |
>10 |
CDK 4/6 gátló |
|
|
CDKN2A |
deléció |
5 |
? |
|
|
CDKN1B |
alteráció |
1-5 |
? |
|
|
CDK4 |
amplifikáció |
1-5 |
CDK 4/6 gátló |
|
|
Rb |
mutáció, deléció |
5-10 |
CDK 4/6 gátló rezisztencia! |
|
|
|
|
|
|
|
DNS repair |
BRCA1 |
mutáció, deléció |
1-5 |
PARP inhibitor |
|
|
BRCA2 |
mutáció, deléció |
1-5 |
PARP inhibitor |
|
|
ATM |
mutáció |
1-5 |
PARP inhibitor |
|
|
ATR |
mutáció |
1-5 |
PARP inhibitor |
|
|
p53 |
mutáció |
>10 |
? |
|
|
|
|
|
|
|
ER útvonal |
ESR1 |
mutáció, amplifikáció |
>10 |
? |
|
|
GATA3 |
mutáció |
5-10 |
HT |
|
|
FoxA1 |
mutáciió |
1-5 |
HT |
|
|
|
|
|
|
|
Egyéb |
NOTCH3 |
amplifikáció |
1-5 |
NOTCH gátló |
|
|
NTRK 1-3 |
fúzió |
<1 |
entrectinib, larotrectinib |
|
|
TMB |
|
|
immunterápia |
|
|
MMR |
|
|
immunterápia |
Ugyanazt a genetikai eltérést több módszerrel is lehet igazolni. Itt a HER2 pozitív daganatokra jellemző HER2 amplifikáció vizsgálati lehetőségeit és igazolását mutatjuk be Slamon D. amerikai professzor történelmi jelentőségű publikációját felhasználva (2. ábra, Slamon SJ, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer Science 244(4905):707-12, 1989).
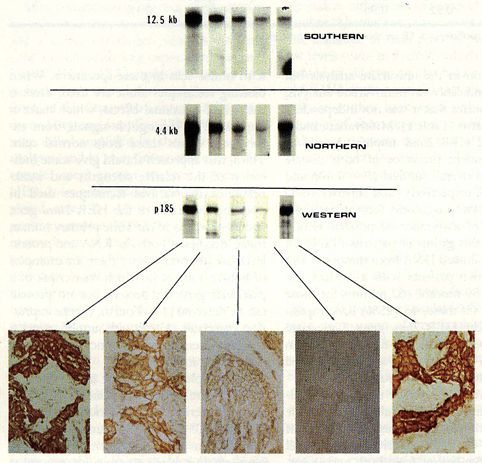
3.2 ábra Különböző technikák ugyanazon genetikai elváltozás kimutatására. DNS, RNS és fehérje szintű mennyiségi kimutatások, valamint a HER2 fehérje szöveti eloszlásának megjelenítése látható az ábrákon.
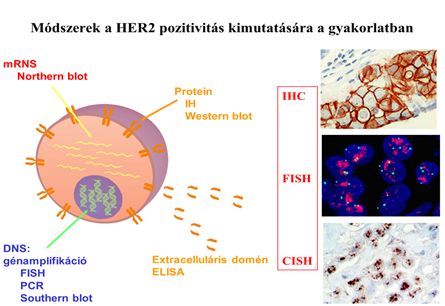
3.3 ábra Rutin patológiai diagnosztikai módszerek a HER2 molekula kimutatására
A HER2 pozitivitás vizsgálata immár két évtizede rutin feladat. A gyakorlatban immunhisztokémiai és/vagy FISH/CISH eljárást alkalmazunk.
3.3 ÖRÖKLETES EMLŐRÁKHOZ KAPCSOLHATÓ GÉNHIBÁK
A mintegy 10%-ban előforduló örökletes emlőrákok kialakulásáért valamilyen örökletes (csírasejtes) génhiba (3.4 Táblázat) tehető felelőssé, mely az érintett családtagokban tipikus daganatok viszonylag fiatal életkorban történő halmozódását okozhatja. E gének többsége az örökítőanyag (DNS) javító mechanizmusok szereplője („DNS repair gének”), kórokozó mutációjuk hibás működést eredményez, mely jellemző szervek daganatképződéséhez vezet.
Az örökletes emlőrákkal kapcsolatos gének vizsgálatát a szervezet bármelyik sejtjéből végezhetik, de általában vérvétellel, vagy szájnyálkahártya törléssel veszik az ehhez szükséges mintát. A vizsgálat sokszor a BRCA gének 5 leggyakoribb mutációjának vizsgálatára terjed ki, de akár a BRCA1 és BRCA2 gének teljes szekvenálása, vagy további rizikógének vizsgálata is szükséges lehet. A vizsgálat indokolt esetben szűrésként egészséges egyénnél is megtörténhet esetleges daganatkockázat tisztázására. A vizsgálat előtt mindig történik konzultáció orvos genetikussal.
3.4 táblázat Lehetséges örökletes génhibák emlő-, petefészek-, hasnyálmirigy-, vagy prosztata daganat hátterében
|
Kórkép |
Génhiba |
Rákrizikó |
Lehetséges célpont, célzott terápia |
|
Örökletes emlő- és petefészekrák |
BRCA1/2, APC, ATM, BARD1, BRIP1, CHEK2, MLH1, MSH6, NBN, NF1, PALB2, PMS2, RAD50, RAD51C, RAD51D
|
emlő, petefészek, pankreász, prosztata, férfi emlőrák, vastagbél |
HRD (platina, PARP-gátló) |
|
Lynch-I, II szindróma |
MSH2, MLH1, MSH6, PMS2, EPCAM
|
vastagbél, méhtest, petefészek, GI, agydaganat, emlő |
immunellenőrző pont (gátló) |
|
Li–Fraumeni-szindróma |
TP53 |
emlő, lágyrész-szarkóma, csontszarkóma, agydaganat, leukémia, mellékvesekéreg |
|
|
Cowden-szindróma |
PTEN |
emlő, pajzsmirigy, méhtest, petefészek, GI |
|
|
Örökletes lobuláris emlőrák/gyomorrák |
CDH1 |
emlő, gyomor |
EGFR-család (EGFR-gátlók) |
|
Multiple mole melanóma |
CDKN2A |
melanóma, hasnyálmirigy, emlő |
CDK4/6 (gátló) |
|
Peutz–Jeghers-szindróma |
STK11/LKB1 |
hasnyálmirigy, GI, tüdő, emlő, uterusz, petefészek |
mTOR (gátló)? |
|
Örökletes pankreatitisz |
PRSS1, SPINK1 |
hasnyálmirigy |
|
A legjelentősebb rákrizikót okozó génhibák vastagított betűvel szedve.
HRD: homológ rekombináció deficiencia, PARP: poli(ADP-ribóz) polimeráz